Хроматин как бионаносистема
Направления исследований
- Исследование роли фазовых конденсатов в энхансер-промоторной коммуникации
- Изучение динамики пространственной организации хроматина в ходе эмбрионального развития и клеточной дифференцировки
- Исследование роли эпигенетических модификаций в пространственной организации хроматина
- Разработка молекулярных инструментов для направленной модификации структуры 3D-генома
Используемые методы
-
Методы фиксации конформации хромосомы
3С, 4С, Hi-C, single-cell Hi-C, С-TALE
- Профилирование эпигенетических модификаций и связывания транскрипционных факторов методом ChIP-seq
-
Профилирование транскриптома методом RNA-seq
в том числе в варианте с обогащением библиотек целевыми последовательностями
- Многоцветный 3D-FISH
- Конфокальная микроскопия
-
Стандартные молекулярно-биологические методы
клонирование, выделение и очистка нуклеиновых кислот, Вестерн-блоттинг, ПЦР в реальном времени
-
Работа с культурами клеток млекопитающих
редактирование генома с использованием CRISPR/Cas
Сотрудники
Сотрудники некафедральные: Молодова Мария Николаевна, Сидорова Маргарита Кирилловна, Тюкачева Евгения Александровна
Экспериментальная работа проходит в Лаборатории структурно-функциональной организации хромосом Института биологии гена РАН (г. Москва, ул. Вавилова, д. 34/5)
Студенты 24/25
-
Дукич Мария Миятовна, магистр 1 года
Студенты-дипломники прошлых лет
- Богданова Анна Владимировна
- Антонов Григорий Николаевич
- Арсений Селивановский
- Юлия Эпик
- Штомпель Анастасия Сергеевна (аспирант)
- Маргарита Сидорова
- Мария Молодова
- Михаил Соловьёв
- Василина Ефимова
- Вера Пирогова
- Даниил Никитин
- Илья Флямер
Сотрудничество с российскими и зарубежными лабораториями
Ключевые публикации
- Tiukacheva EA, Ulianov SV, Karpukhina A, Razin SV, Vassetzky Y. (2023) 3D genome alterations and editing in pathology. Molecular Therapy. S1525-0016(23)00068-0.
- Kobets VA, Ulianov SV, Galitsyna AA, Doronin SA, Mikhaleva EA, Gelfand MS, Shevelyov YY, Razin SV, Khrameeva EE. (2023) HiConfidence: a novel approach uncovering the biological signal in Hi-C data affected by technical biases. Briefings in Bioinformatics. bbad044.
- Zakharova V.V., Magnitov M.D., Del Maestro L., Ulianov S.V., Glentis A., Uyanik B., Williart A., Karpukhina A., Demidov O., Joliot V., Vassetzky Y.S., Mege R.-M., Piel M., Razin S.V., Ait-Si-Ali S. (2022) SETDB1 fuels the lung cancer phenotype by modulating epigenome, 3D genome organization and chromatin mechanical properties. Nucleic Acids Research, gkac234.
- Ilyin A.A., Kononkova A.D., Golova A.V., Shloma V.V., Olenkina O.M., Nenasheva V.V., Abramov Y.A., Kotov A.A., Maksimov D.A., Laktionov P.P., Pindyurin A.V., Galitsyna A.A., Ulianov S.V., Khrameeva E.E., Gelfand M.S., Belyakin S.N., Razin S.V., Shevelyov Y.Y. (2022) Comparison of genome architecture at two stages of male germline cell differentiation in Drosophila. Nucleic Acids Research, gkac109.
- Gao M., Veil M., Rosenblatt M., Riesle A.J., Gebhard A., Hass H., Buryanova L., Yampolsky L., Gruning B., Ulianov S.V., Timmer J., Onichtchouk D. (2022) Pluripotency factors determine gene expression repertoire at zygotic genome activation. Nature Communications (13:788).
- Ulianov S.V. and Razin S.V. (2021) The two waves in single-cell 3D genomics. Seminars in Cell and Developmental Biology. 121:143-152.
- Ulianov S.V., Velichko A.K., Magnitov M.D., Luzhin A.V., Golov A.K., Ovsyannikova N., Kireev I.I., Gavrikov A.S., Mishin A.S., Garaev A.K., Tyakht A.V., Gavrilov A.A., Kantidze O.L., Razin S.V. (2021) Suppression of liquid–liquid phase separation by 1,6-hexanediol partially compromises the 3D genome organization in living cells. Nucleic Acids Research, gkab249.
- Ulianov S.V., Zakharova V.V., Galitsyna A.A., Kos P.I., Polovnikov K.E., Flyamer I.M., Mikhaleva E.A., Khrameeva E.E., Germini D., Logacheva M.D., Gavrilov A.A., Gorsky A.S., Nechaev S.K., Gelfand M.S., Vassetzky Y.S., Chertovich A.V., Shevelyov Y.Y., Razin S.V. (2021) Order and stochasticity in the folding of individual Drosophila genomes. Nature Communications (12:41).
- Gavrilov A.A., Zharikova A.A., Galitsyna A.A., Luzhin A.V., Rubanova N.M., Golov A.K., Petrova N.V., Logacheva M.D., Kantidze O.L., Ulianov S.V., Magnitov M.D., Mironov A.A., Razin S.V. (2020) Studying RNA-DNA interactome by Red-C identifies noncoding RNAs associated with various chromatin types and reveals transcription dynamics. Nucleic Acids Research. 48(12), 6699–6714.
- Golov A.K., Ulianov S.V., Luzhin A.V., Kalabusheva E.P., Kantidze O.L., Flyamer I.M., Razin S. V., Gavrilov A.A. (2019) C-TALE, a new cost-effective method for targeted enrichment of Hi-C/3C-seq libraries. Methods, 1-32.
- Ulianov S.V., Doronin S.S., Khrameeva E.E., Kos P.I., Luzhin A.V., Starikov S.S., Galitsyna A.A., Nenasheva V.V., Ilyin A.A., Flyamer I.M., Mikhaleva E.A., Logacheva M.D., Gelfand M.S., Chertovich A.V., Gavrilov A.A., Razin S.V., Shevelyov Y.Y. (2019) Nuclear lamina integrity is required for proper spatial organization of chromatin in Drosophila. Nature Communications (10:1176)
- Ulianov S.V., Galitsyna A.A., Flyamer I.M., Golov A.K., Khrameeva E.E., Imakaev M.V., Abdennur N.A., Gelfand M.S., Gavrilov A.A. and Razin S.V. (2017) Activation of the alpha-globin gene expression correlates with dramatic upregulation of nearby non-globin genes and changes in local and large-scale chromatin spatial structure. Epigenetics and Chromatin, 10, 35.
- Kovina A.P., Petrova N.V., Gushchanskaya E.S., Dolgushin K.V., Gerasimov E.S., Galitsyna A.A., Penin A.A., Flyamer I.M., Ioudinkova E.S., Gavrilov A.A., Vassetzky Y.S., Ulianov S.V., Iarovaia O.V., Razin S.V. (2017) Evolution of the Genome 3D Organization: Comparison of Fused and Segregated Globin Gene Clusters. Molecular Biology and Evolution, 34, 1492-1504.
- Ulianov S.V., Tachibana-Konwalski K. and Razin S.V. (2017) Single-cell Hi-C bridges microscopy and genome-wide sequencing approaches to study 3D chromatin organization. BioEssays, 39(10).
- Flyamer I.M., Gassler J., Imakaev M., Brandao H.B., Ulianov S.V., Abdennur N., Razin S.V., Mirny L.A. and Tachibana-Konwalski K. (2017) Single-nucleus Hi-C reveals unique chromatin reorganization at oocyte-to-zygote transition. Nature, 544, 110-114.
- Ulianov S.V., Khrameeva E.E., Gavrilov A.A., Flyamer I.M., Kos P., Mikhaleva E.A., Penin A.A., Logacheva M.D., Imakaev M.V., Chertovich A. et al. (2016) Active chromatin and transcription play a key role in chromosome partitioning into topologically associating domains. Genome Research, 26, 70-84.
Группа занимается изучением механизмов формирования и поддержания пространственной структуры хроматина, её динамики и роли в регуляции работы генома.
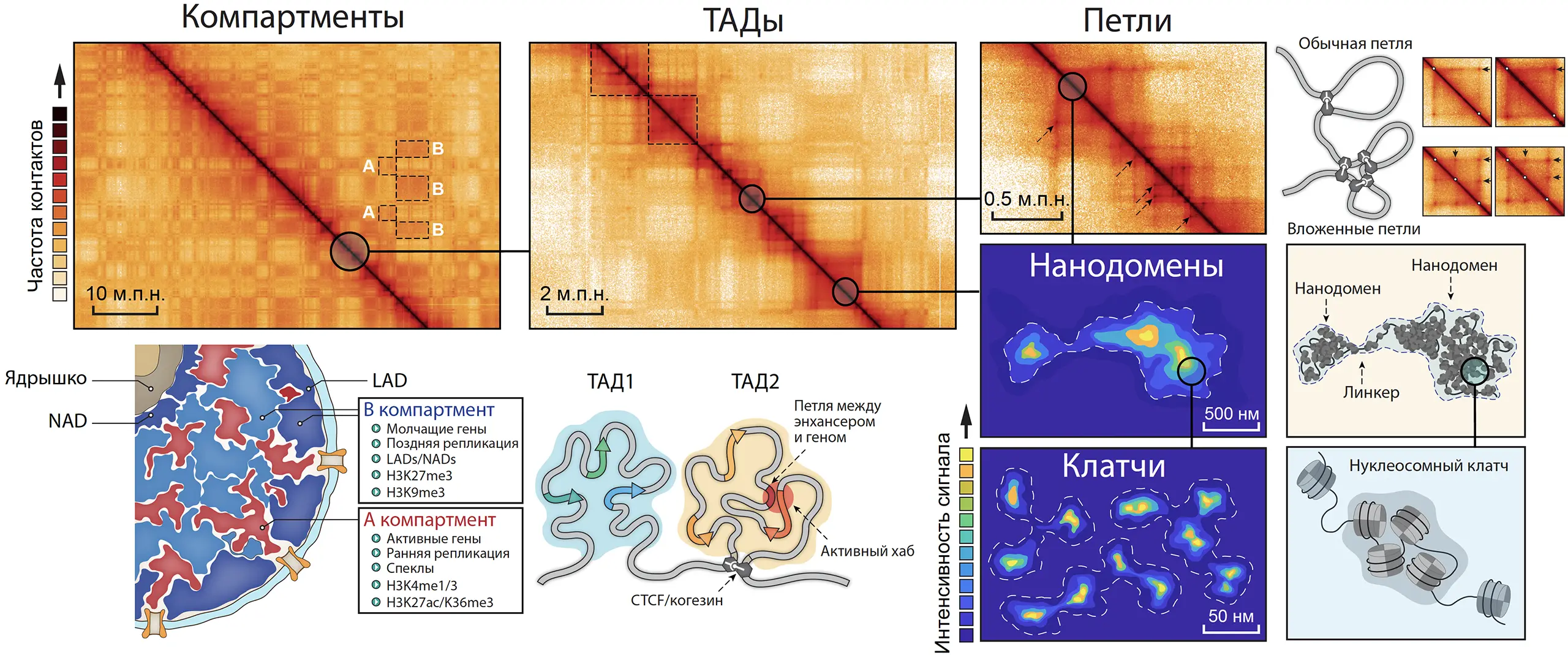
Интерфазный хроматин эукариот упакован иерархично. На самом малом масштабе нуклеосомы формируют т.н. клатчи, или нанодомены – неструктурированные агломераты, включающие до нескольких десятков нуклеосом. Их средний размер зависит от общего уровня ацетилирования хроматина, что указывает на электростатические межнуклеосомные взаимодействия как механизм их формирования. На масштабе порядка 50-500 т.п.н. хроматин свёрнут в динамично организованные глобулы, которые обычно называют контактными доменами, или топологически ассоциированными доменами (ТАД). Эти структуры как правило разделяют генные локусы и определяют зоны действия регуляторных систем. Внутри них устанавливаются регуляторные контакты между промоторами и управляющими элементами генома. Зачастую границы ТАДов совпадают с границами эпигенетических доменов и репликонов, а также с горячими точками геномных перестроек, что позволяет говорить о них, как структурно-функциональных единицах хроматина. На масштабе миллионов пар нуклеотидов ТАДы взаимодействуют друг с другом не случайным образом, предпочтительно образуя контакты с доменами, имеющими тот же эпигенетический статус. Это приводит к пространственной сегрегации активных и неактивных районов генома в так называемых А (активный) и В (неактивный) компартментах. Важно, что пространственная структура хроматина значительно варьирует в индивидуальных клетках популяции. Один и тот же район генома, идентифицируемый как ТАД в эксперименте на популяции клеток, может принимать различные конфигурации от плотной глобулы до полностью деконденсированной нити в индивидуальных клетках. То же верно и для компартментов: на уровне единичных клеток в данный конкретный момент времени пространственное разделение активных и неактивных локусов в пределах хромосомы может быть полным, частичным или отсутствовать вовсе.
Детальное описание этих структур, механизмов их формирования и роли в регуляции работы генома важно как с фундаментальной, так и с практической точки зрения, поскольку известно, что некоторые тяжёлые заболевания человека вызваны не мутациями в кодирующих или регуляторных областях генома, а перестройками его пространственной организации.
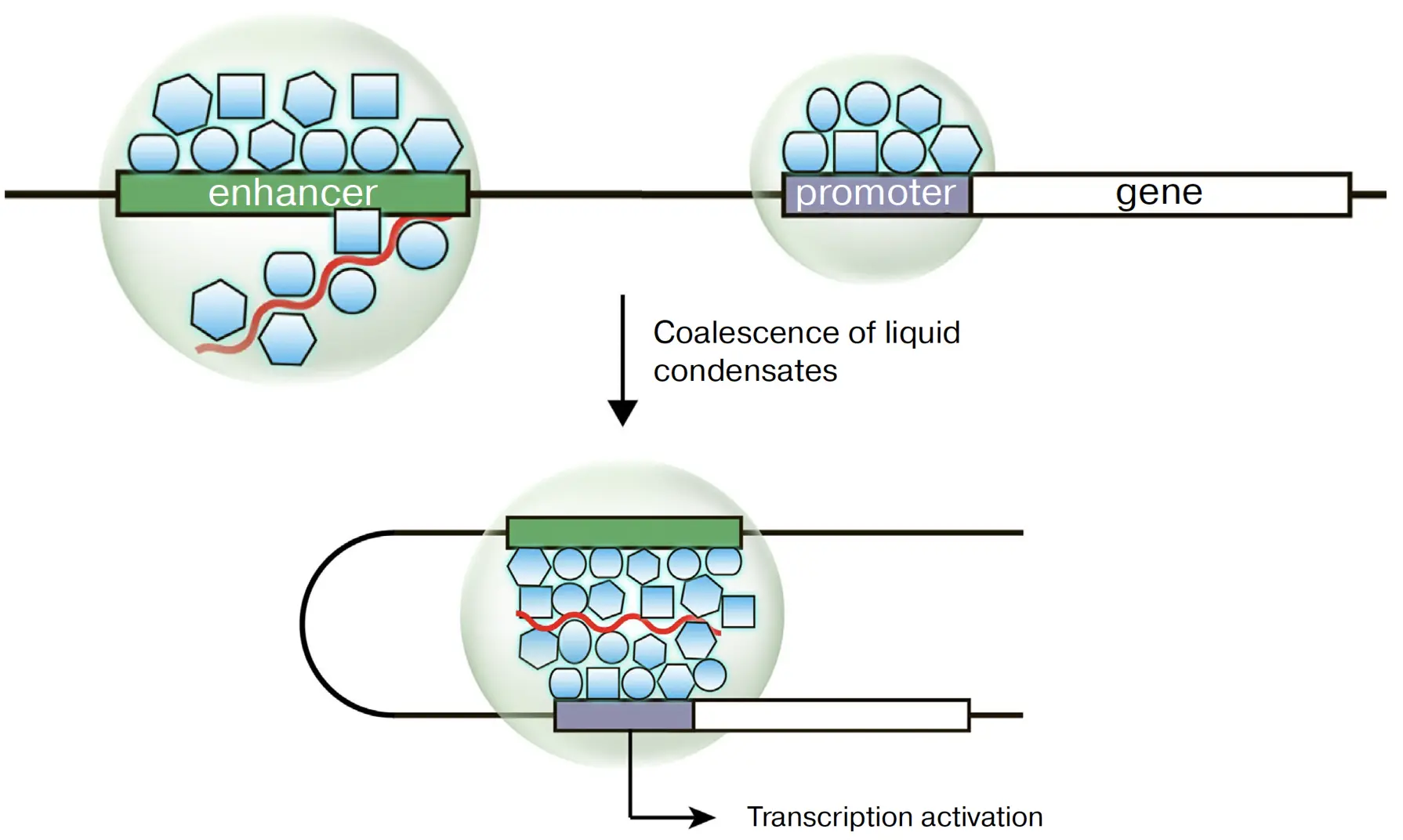
Исследование роли фазовых конденсатов в энхансер-промоторной коммуникации
Разделение фаз в жидкости (англ. liquid-liquid phase separation) – форма фазового перехода, при которой изначально гомогенный раствор спонтанно разделяется на две компоненты (фазы), одна из которых оказывается значительно обогащена (плотная фаза), а вторая – обеднена молекулами растворённого вещества (лёгкая фаза). Плотная фаза как правило формирует т.н. капли (англ. droplets), или конденсаты, внутри лёгкой фазы, которые могут существовать продолжительное время в метастабильном состоянии – изолированно или сливаясь друг с другом. Многие белки, имеющие в своём составе неструктурированные домены и связывающиеся с энхансерами и промоторами (транскрипционные факторы, РНК-полимераза II), способны формировать конденсаты за счёт белок-белковых и белок-РНК взаимодействий. В этой связи образование контакта между энхансером и промотором можно рассматривать как слияние «энхансерного» и «промоторного» конденсатов с формированием микроокружения, эффективно активирующего промотор. Мы исследуем справедливость этого предположения и возможные механизмы, обеспечивающие эффективные взаимодействия между конденсатами на модели локуса кератиновых генов человека. В частности, нас интересует роль когезин-зависимой экструзии в этом процессе и возможность управляемого создания конденсатов на заранее выбранном участке генома путём привлечения транскрипционных факторов и компонентом медиаторного комплекса.
Изучение динамики пространственной организации хроматина в ходе эмбрионального развития и клеточной дифференцировки
Трёхмерная структура хроматина довольно лабильна: она реорганизуется в ответ на разнообразные внутриклеточные и внешние стимулы, в частности, при развитии эмбриона и дифференцировке специализированных клеточных типов. В ходе этих процессов меняются спектры контактов между регуляторными элементами генома, отдельные геномные локусы могут переходить из компартмента в компартмент, может меняться интенсивность взаимодействий между целым хромосомами. Мы изучаем эти процессы на модели раннего эмбрионального развития Danio rerio, при формировании многоклеточных структур миксомицета Dictyostelium discoideum и при дифференцировке кератиноцитов кожи человека.
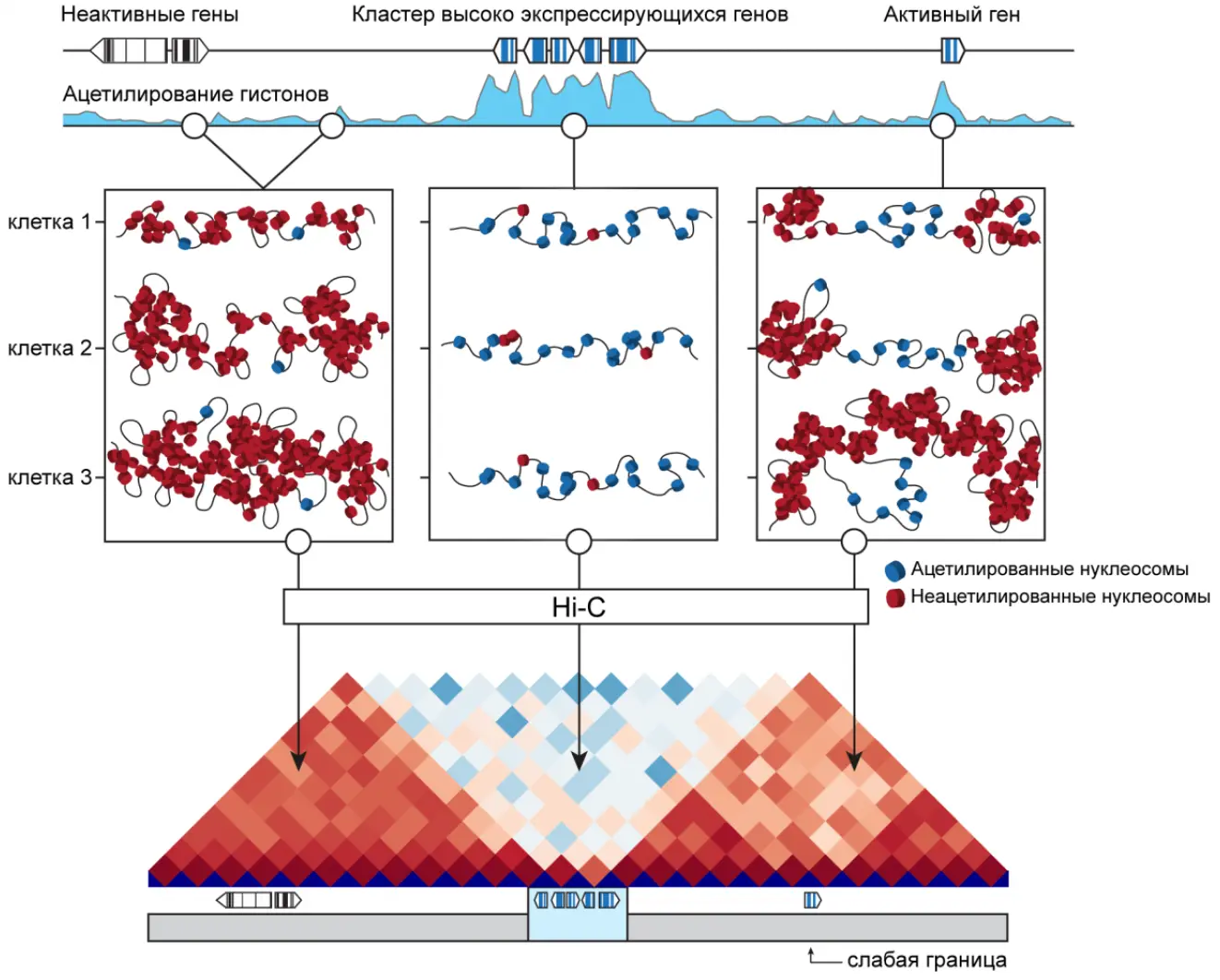
Исследование роли эпигенетических модификаций в пространственной организации хроматина
Нуклеосома – базовая структурная единица хроматина практически всех эукариотических организмов. Разнообразные модификации и вариантные формы гистонов в составе нуклеосом создают так называемый «гистоновый код» или «гистоновый контекст», играющий сигнальную и регуляторную роль при активации и репрессии транскрипции в пределах геномного локуса. Отдельного внимания заслуживает ацетилирование остатков лизина в N-концевых доменах гистонов. Эта модификация препятствует межнуклеосомным взаимодействиям, тем самым способствуя деконденсации хроматина. Целый ряд экспериментальных данных указывает на то, что высокий уровень ацетилирования гистонов может играть роль в установлении границ топологических доменов. Мы занимаемся исследованием этого вопроса на модели культивируемых клеточных линий дрозофилы, в которых мы с помощью низкомолекулярных агентов ингибируем гистоновые ацетилтрансферазы и деацетилазы. Кроме того, мы используем привлечение ацетилтрансфераз внутрь топологических доменов к заранее выбранным геномным локусам, чтобы проверить, приведёт ли это к разделению ТАДа на два домена с границей в точке привлечения ацетилтрансферазы.
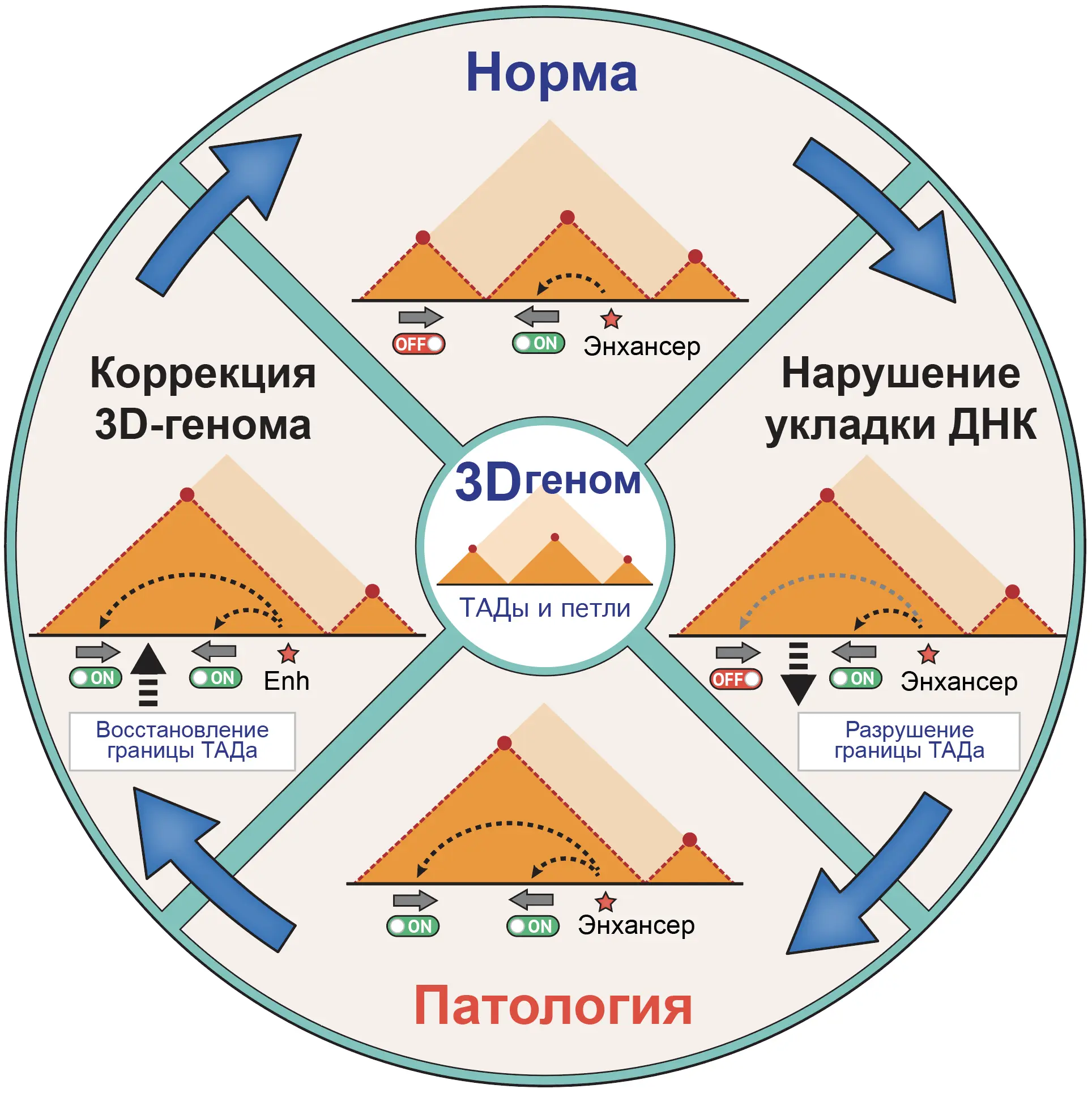
Разработка молекулярных инструментов для направленной модификации структуры 3D-генома
Целый ряд генетически обусловленных заболеваний человека вызван не мутациями в кодирующих или регуляторных областях генома, но изменениями его пространственной структуры. Среди этих заболеваний множество в том числе и социально-значимых: глиомы, ментальные расстройства, диабет второго типа, лимфомы. Их развитие как правило связано с разрушением границ ТАДов или изменением спектра взаимодействий между энхансерами и промоторами. Коррекция подобных нарушений возможна путём индуцибельного привлечения архитектурных белков хроматина – в частности, CTCF. Мы исследуем возможность использования полноразмерной и укороченных форм этого белка для модификации спектра петлевых контактов в различных эпигенетических контекстах генома человека.