Изучение молекулярных основ онкогенеза
Направления исследований
Используемые методы
- Работа с культурами клеток млекопитающих
- Редактирование генома с помощью TALEN и CRISPR/Cas
- Получение стабильных клеточных линий
- Метод 3D FISH
- Конфокальная микроскопия
- In vivo микроскопирование клеток
- Проточная цитофлуориметрия
- ChIP-seq
- NGS
-
Стандартные молекулярно-биологические методы работы с нуклеиновыми кислотами
выделение, разновидности ПЦР
-
Методы работы с белками
колоночная хроматография, электрофорез, иммунохимия
-
Получение рекомбинантных плазмидных конструкций
методами Golden Gate, Gibson Assembly, рестрикционного клонирования
Руководитель группы
Сотрудники
Студенты 25/26
- Софья Замалутдинова, аспирант
- Николай Николаев, студент
-
Екатерина Моргацкая, студентка-магистр
Студенты-дипломники с 2011 года
2025
Виктория Иванова, бакалавр — «Получение клеточной модели хромосомной транслокациии MLL-AF6, ассоциированной с острым лейкозом»
2024
Николай Грушецкий, бакалавр — «Создание клеточной модели хромосомной перестройки KMT2A-BTBD18, ассоциированной с острым лейкозом»
Полина Калитина, магистр — «Изучение механизмов онкогенеза при хромосомных перестройках с участием гена КМТ2А в клетках человека»
2023
Мария Нечеухина, бакалавр — «Создание клеточной модели для визуализации локусов хроматина с помощью технологии CRISPR-Tag»
2022
Полина Калитина, бакалавр — «Создание клеточной линии с системой AID-деплеции субъединицы когезина RAD21»
Анастасия Петренко, бакалавр — «Изучение внутриядерной подвижности генов-партнеров по транслокациям методом CRISPR-имаджинга»
2021
Алексей Замалутдинов, магистр — «Создание клеточных моделей острого лейкоза, несущих хромосомные перестройки с участием гена KMT2A»
Софья Замалутдинова, магистр — «Экспрессия гена белка-переносчика холестерина быка в клетках Escherichia coli и изучение функциональных характеристик гетерологичного белка»
2020
Владимир Вьюшков, магистр — «Создание клеточной модели для наблюдения за динамикой локусов хроматина в живой клетке»
2018
Владимир Вьюшков, бакалавр — «Создание клеточной модели ассоциированных с лейкозами хромосомных транслокаций»
2016
Валерия Зинина, бакалавр — «Влияние функциональных доменов муцина MUC1 на метастатический потенциал опухолевых клеток человека»
Анастасия Петушкова, бакалавр — «Исследование ферментативной активности рекомбинантной папаин-подобной протеиназы пшеницы тритикаин-альфа»
Анастасия Лабудина, бакалавр — «Экспрессия белков холестерингидроксилазной/ лиазной системы в форме самопроцессирующегося полипротеина в клетках эукариот»
2015
Екатерина Лучкина, бакалавр — «Роль RGD-связывающих интегринов в малигнизации опухолевых клеток».
2014
Николай Ломов, специалист — «Характеристика позиционирования протоонкогенов в ядре в условиях ингибирования ДНК-топоизомераз»
Юлия Кондратенко, специалист — «Исследование влияния функциональных доменов муцина MUC1 на метастатический потенциал опухолевых клеток человека in vitro»
2012
Людмила Агеева Дипломная работа «Сверхэкспрессия нуклеолина приводит к увеличению числа двухцепочечных разрывов ДНК в случае обработки клеток HeLa этопозидом»
2011
Вадим Котов Курсовая работа «Создание ДНК-конструкта, содержащего ген флуоресцентного белка, как основа тест-системы для оценки рекомбиногенной активности противораковых лекарственных препаратов»
Людмила Агеева Курсовая работа «Оценка влияния сверхэкспресии нуклеолина на чувствительность культивируемым клеток животных к этопозиду методом ДНК-комет в нейтральных условиях» 2011 г.
Сотрудничество с зарубежными лабораториями
Группа сотрудничает с лабораторией «Хроматин, биология развития и рак» Института Канцерогенеза им. Густава Русси (CNRS, Вильжуиф, Франция).
Публикации сотрудников группы
The Influence of Cohesin on the Short-Scale Dynamics of Intact and Damaged Chromatin in Different Phases of the Cell Cycle
Viushkov Vladimir S., Lomov Nikolai A., Kalitina Polina O., Potashnikova Daria M., Shtompel Anastasia S., Ulianov Sergey V., Razin Sergey V., Rubtsov Mikhail A.
в журнале International Journal of Molecular Sciences, издательство MDPI (Basel, Switzerland), том 26, № 18 DOI
2024 Сравнение двух версий системы CRISPR-Sirius для прижизненной визуализации границ топологически ассоциированных доменов
Viushkov Vladimir S., Lomov Nikolai A., Rubtsov Mikhail A.
в журнале Cells, издательство MDPI (Basel, Switzerland), том 13, № 17, с. 1440-1440 DOI
2023 Механизмы развития вторичных лейкозов, вызванных терапией с применением ингибиторов ДНК-топоизомераз
Lomov Nikolai A., Viushkov Vladimir S., Rubtsov Mikhail A.
в журнале Biochemistry (Moscow), издательство Pleiades Publishing, Ltd (Road Town, United Kingdom), том 88, № 7, с. 892-911 DOI
2023 Реактивация вируса Эпштейна-Барр индуцирует пространственную близость MYC-IGH и t(8;14) в В-клетках
Sall Fatimata Bintou1, 2, Shmakova Anna2, 3, 4, Karpukhina Anna2, 3, Tsfasman Tatyana2, Lomov Nikolai2, 5, Canoy Reynand Jay2, Boutboul David6, Oksenhendler Eric6, Toure Awa Oumar1, Lipinski Marc2, Wiels Joëlle2, Germini Diego2, Vassetzky Yegor2, 3
в журнале Journal of Medical Virology, издательство John Wiley & Sons Inc. (United States), том 95, № 3 DOI
2022 Анализ активности человеческого стероидогенного острого регуляторного белка (STARD1), экспрессируемого в клетках Escherichia coli
Zamalutdinova Sofia V., Isaeva Ludmila V., Zamalutdinov Aleksei V., Faletrov Yaroslav V., Rubtsov Mikhail A., Novikova Ludmila A.
в журнале Biochemistry (Moscow), издательство Pleiades Publishing, Ltd (Road Town, United Kingdom), том 87, № 9, с. 1015-1020 DOI
2022 Клеточные модели с индуцируемыми онкогенными транслокациями позволяют оценить потенциал лекарств в отношении благоприятных вторичных транслокаций
Shmakova Anna, Lomov Nikolai, Viushkov Vladimir, Tsfasman Tatyana, Kozhevnikova Yana, Sokolova Darina, Pokrovsky Vadim, Syrkina Marina, Germini Diego, Rubtsov Mikhail, Vassetzky Yegor
в журнале Cancer communications, издательство Wiley & Sons (Chichester, Sussex, UK, England) DOI
2022 Экспрессия генов, кодирующих белки-переносчики холестерина, для повышения эффективности системы P450scc в клетках E. coli
Zamalutdinova S., Isaeva L., Rubtsov M., Novikova L.
в журнале FEBS open bio, издательство John Wiley & Sons Inc. (United States), том 12, № S1, с. 315-315 DOI
2022 Рекуррентные транслокации при лейкемии, связанной с ингибитором топоизомеразы, определяются особенностями разрывов ДНК, а не близостью транслоцирующих генов
Lomov N.A., Viushkov V.S., Ulianov S.V., Gavrilov A.A., Alexeyevsky D.A., Artemov A.A., Razin S.V., Rubtsov M.A.
в журнале International Journal of Molecular Sciences, издательство MDPI (Basel, Switzerland), том 23 DOI
2022 На пути к раскрытию природы коротких транскриптов SERPINA1: избегание основного контроля ORF для трансляции С-концевых пептидов альфа1-антитрипсина
Maslakova A.A., Didych D.A., Golyshev S.A., Katrukha I.A., Viushkov V.S., Zamalutdinov A.V., Potashnikova D.M., Rubtsov M.A., Smirnova O.V., Orlovsky I.V.
в журнале International Journal of Biological Macromolecules, издательство Elsevier BV (Netherlands), том 203, с. 703-717 DOI
2022 Визуализация генома: экспериментальные подходы к визуализации хроматина живых клеток
Viushkov Vladimir S., Lomov Nikolai A., Rubtsov Mikhail A., Vassetzky Yegor S.
в журнале Cells, издательство MDPI (Basel, Switzerland), том 11, № 24 DOI
2022 Анализ активности стероидогенного регуляторного белка острой фазы (STARD1) человека в клетках Escherichia coli
Замалутдинова С.В., Исаева Л.В., Замалутдинов А.В., Фалетров Я.В., Рубцов М.А., Новикова Л.А.
в журнале Биохимия, издательство ИКЦ «Академкнига» (Москва), том 87, № 9, с. 1334-1341 DOI
2021 Использование стратегии на основе вирусного пептида 2A для реконструкции стероидогенной системы бычьего P450scc в S. cerevisiae
Efimova Vera S., Isaeva Ludmila V., Orekhov Philipp S., Bozdaganyan Marine E., Rubtsov Mikhail A., Novikova Ludmila A.
в журнале Journal of Biotechnology, издательство Elsevier BV (Netherlands), том 325, с. 186-195 DOI
2020 Цитогенетические и молекулярно-генетические методы выявления хромосомных транслокаций на примере гена КМТ2А
Lomov Nikolai, Zerkalenkova Elena, Lebedeva Svetlana, Viushkov Vladimir, Rubtsov Mikhail
в журнале Critical Reviews in Clinical Laboratory Sciences, издательство Taylor & Francis (United Kingdom) DOI
2020 Direct ENIT: простой и надежный инструмент для проверки эффективности гРНК путем отслеживания индуцированной хромосомной транслокации
Lomov Nikolai A., Viushkov Vladimir S., Zamalutdinov Aleksei V., Sboeva Maria D., Rubtsov Mikhail A.
в журнале METHODSX, том 7 DOI
2020 Гормоны как эффективные регуляторы коротких транскриптов SERPINA1, кодирующих биоактивные пептиды альфа1-антитрипсина in vitro
Maslakova A.A., Funtova Yu S., Rubtsov M.A., Viushkov V.S., Orlovsky I.V., Smirnova O.V.
в журнале Molecular Biology of the Cell, издательство American Society for Cell Biology (United States), том 31, № 26, с. 2863-2863 DOI
2020 Новые соединения, подобные 20-гидроксихолестеролу, с флуоресцентными NBD или алкиновыми метками: синтез, взаимодействие in silico с белками и поглощение дрожжевыми клетками
Faletrov Y.V., Efimova .V.S, Horetski .M.S, Tugaeva K V., Frolova N.S., Quingquing Lin, Isaeva L.V., Rubtsov M A., Sluchanko N.N., Novikova L A., Shkumatov V M.
в журнале Chemistry and Physics of Lipids, издательство Elsevier BV (Netherlands), том 227 DOI
2020 СРАВНЕНИЕ ХИМИОТЕРАПЕВТИЧЕСКИХ ПРЕПАРАТОВ НА ПРЕДМЕТ РИСКА ВОЗНИКНОВЕНИЯ ВТОРИЧНЫХ ЛЕЙКОЗОВ
Ломов Н.А., Вьюшков В.С., Соколова Д.В., Покровский В.С., Рубцов М.А.
в журнале Гематология и трансфузиология, издательство Медицина (М.), том 65, № 1, с. 34-34
2019 Анализ активности in vivo белков системы гидроксилазы/лиазы холестерина крупного рогатого скота, экспрессированных в Escherichia coli
Efimova1 V.S., Isaeva L.V., Rubtsov M.A., Novikova L.A.
в журнале Molecular Biotechnology, издательство Springer International Publishing AG (Cham, Switzerland), том 61, № 4, с. 261-273 DOI
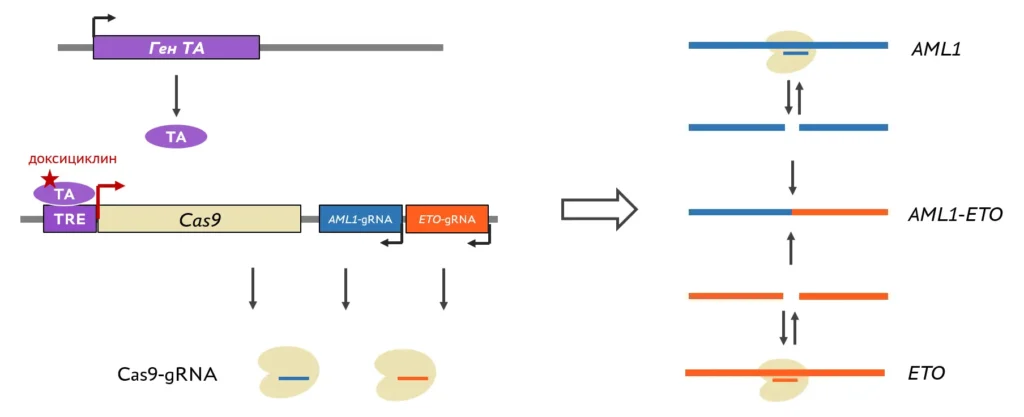
2019 Клеточная модель индуцируемой транслокации AML1-ETO
Lomov N.A., Viushkov V.S., Rubtsov M.A.
в журнале Biopolymers and Cell, издательство Naukova Dumka (Ukraine), том 35, № 3, с. 223-223 DOI
2019 От увеличения количества тандемных повторов через снижение сиалирования до снижения уровня экспрессии MUC1
Syrkinaa M.S., Viushkov V.S., Potashnikova D.M., Veiko V.P., Vassetzky Y.S., Rubtsov M.A.
в журнале Journal of Cellular Biochemistry, издательство
Механизмы индукции вторичных лейкозов, вызванных химиотерапевтическими препаратами. Клеточные модели лейкозов
Группа изучает механизмы возникновения некоторых видов рака крови: лейкозов и ВИЧ-ассоциированной лимфомы Беркитта.
Для этого на основе клеток человека создаются клеточные линии: геном клеток редактируется с помощью систем CRISPR/Cas и TALEN.
Также создаются клеточные линии для изучения лейкозов с участием протоонкогена MLL и клеточные линии для прижизненного наблюдения за отдельными локусами в ядре.
Помимо методов, стандартных для молекулярной и клеточной биологии, используются FISH и конфокальная микроскопия.
Вторичные лейкозы
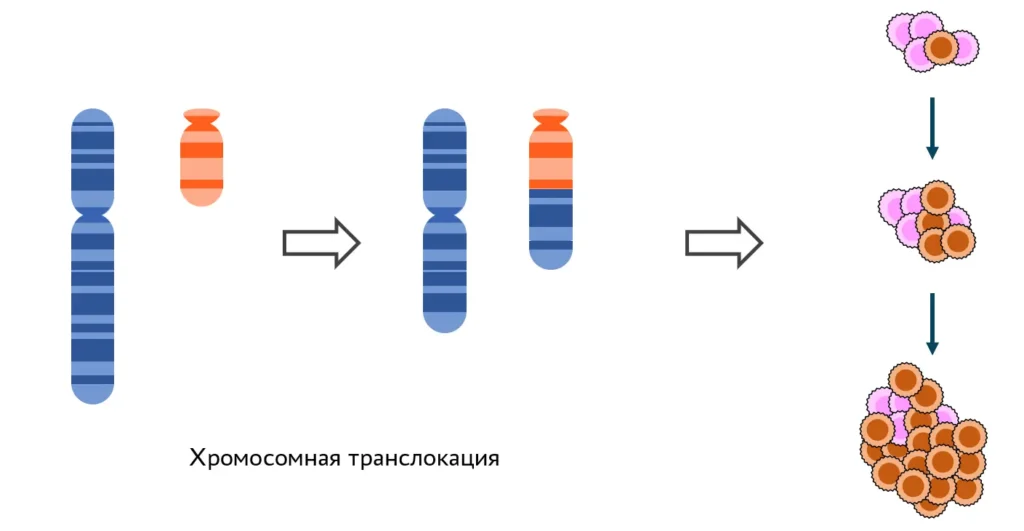
Возникновение лейкозов — один из побочных эффектов химиотерапии опухолей. Раковые клетки, которые быстро делятся, чувствительны к препаратам, индуцирующим двуцепочечные разрывы ДНК. В здоровых клетках системы репарации справляются с такими повреждениями. Однако репарация чаще всего идет по пути негомологичного соединения концов разрыва. Такой механизм допускает ошибки: могут соединиться совсем не те концы, что были результатом одного разрыва. Иногда так соединяются фрагменты разных хромосом, и получаются хромосомные транслокации, приводящие к раковой трансформации клетки. Лейкозы, возникшие как следствие химиотерапии, называют вторичными, обусловленными лечением (t-AML, Therapy-related Acute Myeloid Leukemia). Наша группа изучает механизмы, которые определяют формирование транслокаций, ведущих к этим заболеваниям.
Подвижность протоонкогенов
Чтобы хромосомная транслокация стала причиной лейкоза, на перестроившихся хромосомах в месте соединения должны оказаться определенные гены. Так происходит, если в этих генах одновременно будут внесены разрывы, и концы разрывов окажутся в одном месте ядра. С помощью флуоресцентных зондов мы визуализировали перестраивающиеся гены и их хромосомы. Препараты анализировали на конфокальном микроскопе с последующим компьютерным анализом изображений. Также с помощью метода 4С (захват конформации хромосом с последующим высокопроизводительным секвенированием) изучали пространственные контакты перестраивающихся генов с другими участками генома. Наконец, для изучения формирования транслокаций мы создаем клеточные модели.
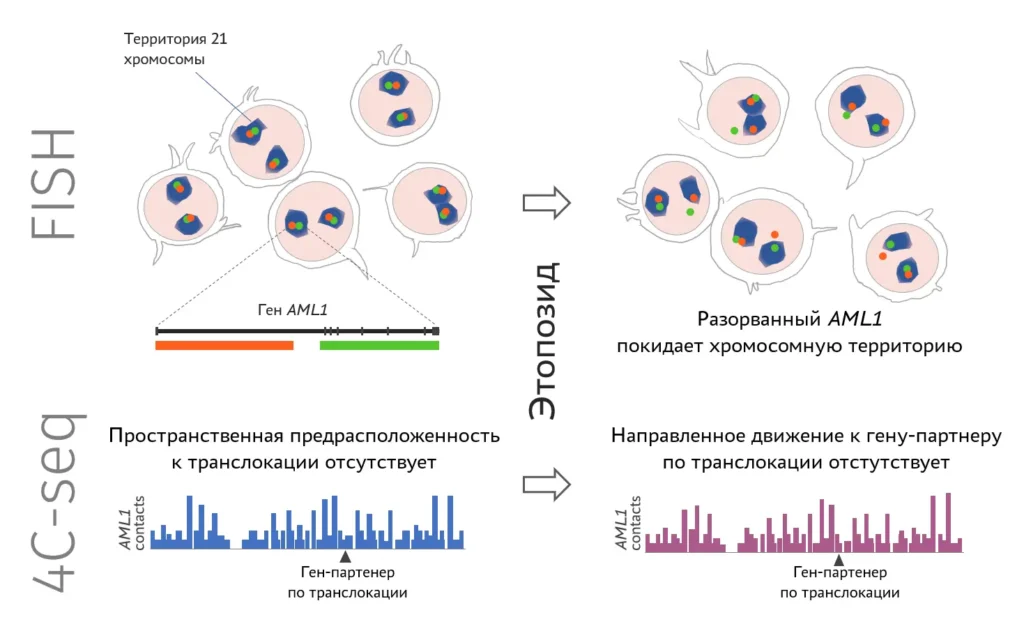
Изучение целостности и подвижности, а также профилей пространственных контактов гена AML1, часто перестраивающегося при вторичных лейкозах вследствие терапии этопозидом. FISH — флуоресцентная in situ гибридизация, 4С-seq — метод изучения пространственных контактов хромосом (от circular chromosome conformation capture). Результаты показывают, что AML1 рвется под действием этопозида, и разрывы приобретают повышенную мобильность, что позволяет перестраиваться между собой генам, которые изначально не были сближены в ядре.
Клеточные модели возникновения транслокаций
ВИЧ-ассоциированные транслокации
Также в рамках совместной российско-французской лаборатории «Laboratoire International Associe №1066 Laboratoire Franko-Russe de Recherche en Oncologie» сотрудники группы изучают механизмы, лежащие в основе ВИЧ-ассоциированных хромосомных транслокаций. Было обнаружено, что вирусный белок Тат, циркулирующий в крови больных, проникает в ядра лимфоцитов, где стимулирует возникновение разрывов внутри генов IgH и СMYC. Последующая релокализация в ядре гена СMYC приводит к тому, что он оказывается рядом с IgH. Перестройка между этими двумя генами приводит к развитию лимфомы Беркитта. Для изучения этого явления были созданы: клеточная линия, в которой индуцируются разрывы в локусах IgH и СMYC, а также линии, в которых индуцируются разрывы только лишь в IgH или СMYC. Полученные клеточные линии используются для изучения влияния реактивации (перехода из латентной в литическую фазу инфекции) вируса Эпштейна-Барр на вероятность развития лимфомы Беркитта.
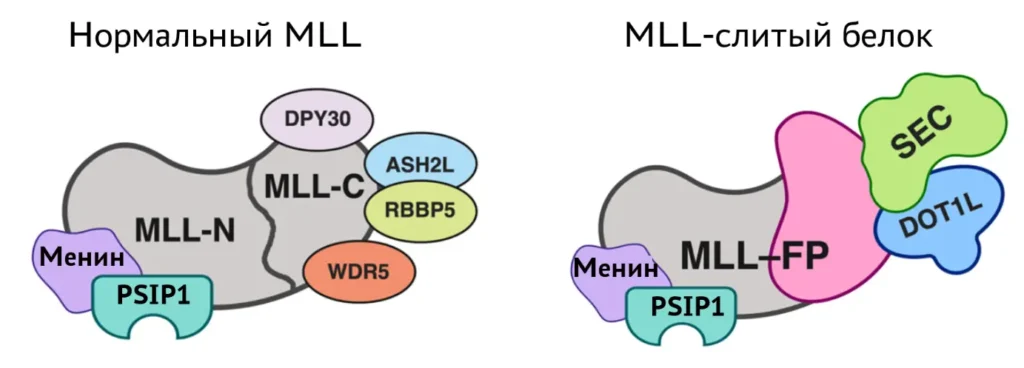
Клеточные модели, содержащие транслокации с участием гена MLL
Перестройки с участием гена MLL (KMT2A) встречаются приблизительно в 10% случаев острых лейкозов со значительным преобладанием в группе детей младше 1 года. Диагностика и терапия этих лейкозов осложняется высокой гетерогенностью хромосомных перестроек – у разных пациентов обнаруживаются как различные гены-партнеры MLL, так и различные точки разрыва внутри самого MLL.
Для гена MLL известно более 90 генов-партнеров по хромосомным транслокациям. Чтобы разобраться, почему генов-партнеров так много, мы получаем клетки с различными транслокациями с участием MLL. Мы моделируем транслокации, варьирующие от хорошо изученных и часто встречающихся до тех, про белковый продукт которых до сих пор ничего неизвестно, чтобы выявить и сравнить изменения их пролиферативных свойств и морфологических характеристик. Для выяснения молекулярных механизмов онкогенеза будет проанализировано изменение транскриптома, а также определен характер эпигенетических меток генов, экспрессия которых будет меняться после воз никновения транслокации.
Работа ведется в сотрудничестве с лабораторией цитогенетики и молекулярной генетики НМИЦ детской гематологии, онкологии и гематологии ДГОИ им. Дмитрия Рогачева.
Клеточные модели для прижизненного наблюдения за динамикой локусов в ядре
Такие клеточные модели создаются с помощью систем для прижизненного наблюдения за динамикой локусов, таких как система ParB/Int (ANCHOR) и системы CRISPR-имаджинга. Система ANCHOR основана на компонентах сегрегации бактериальных хромосом INT—ParB и состоит из двух основных элементов: специальных якорных последовательностей и узнающих их белков. Последовательность ANCH интегрирована в изучаемый локус. Бактериальные белки OR, слитые с флуоресцентным белком, узнают эту последовательность и олигомеризуются на ней, позволяя наблюдать in vivo за перемещением локуса с помощью микроскопии. Преимущество системы заключается в том, что интеграция ANCH в изучаемые локусы не влияет на их естественную динамику в ядре.
Технология может быть адаптирована для микроскопии сверхвысокого разрешения, что позволит изучать архитектуру хроматина на более тонком уровне, чем возможно с помощью традиционной конфокальной микроскопии.
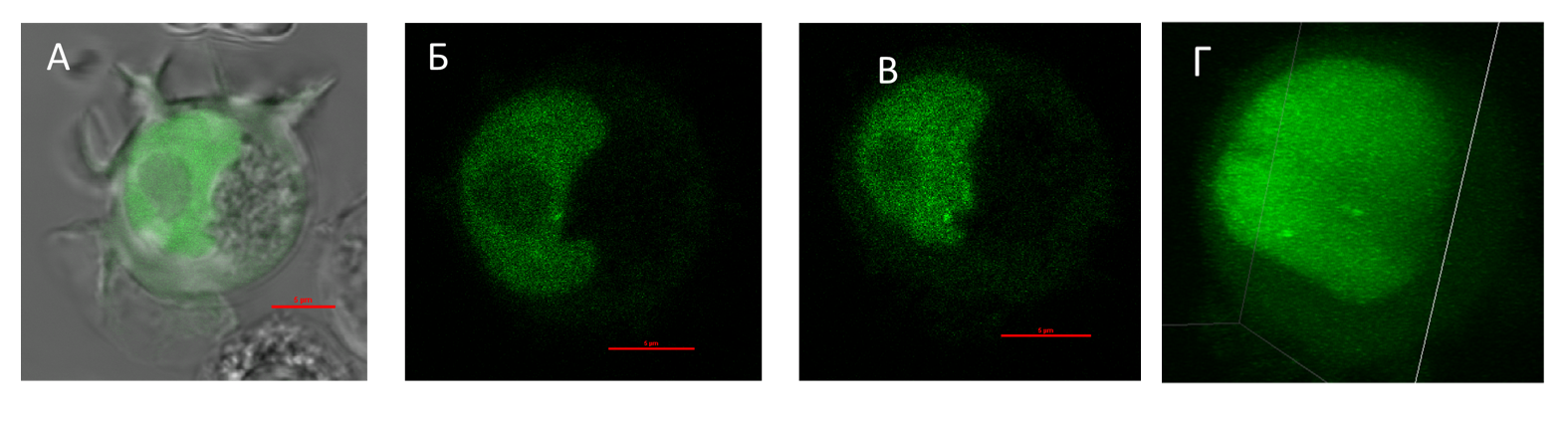
Визуализация локуса MYC. A — наложение изображений в проходящем свете и в канале флуоресценции GFP. Б, В — конфокальные плоскости, в которых находятся 2 аллеля гена MYC. Г — трехмерная реконструкция клетки.
Другой перспективный метод наблюдения за локусами ядра в живой клетке — CRISPR-имаджинг. Он базируется на использовании каталитически неактивной Cas9 (dCas9), которая привлекается к локусу-мишени с помощью гидовой РНК. Наша группа применяетодну из таких технологий — CRISPR-Sirius. В ней для усиления яркости сигнала к последовательности гидовой РНК добавляются аптамерные модули — РНК-шпильки бактериофагов MS2 и PP7, с которыми связываются белки этих бактериофагов (MCP и PCP), слитые с флуоресцентными белками.
Исследование формирования топологически ассоциированных доменов хроматина на живых клетках
Работа над этим проектом ведется вместе с группой С.В.Разина и С.В.Ульянова.
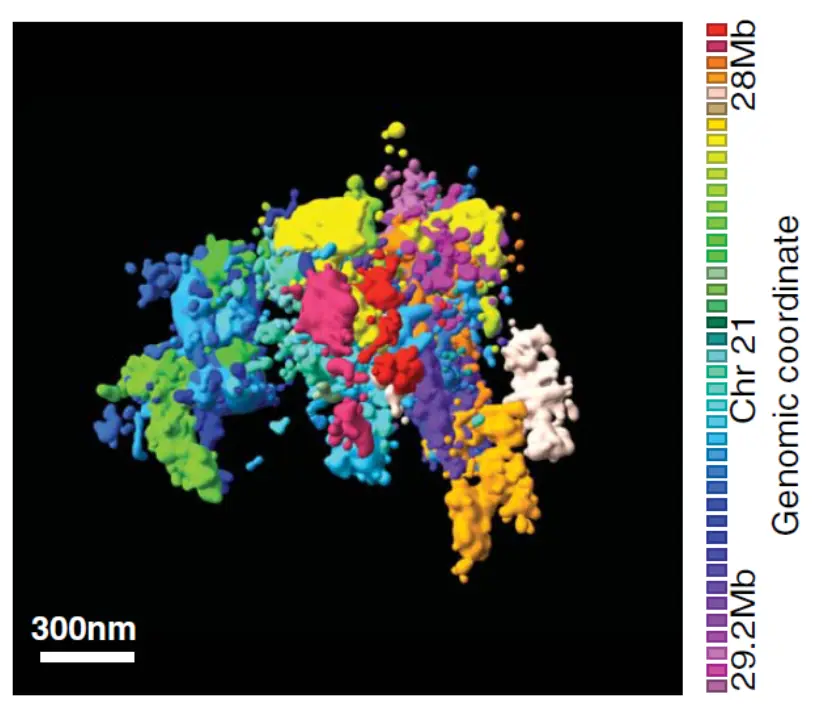
Биохимические методы изучения топологии генома, такие как Hi-C, выявили характерные черты укладки эукариотических хромосом — наличие топологически ассоциированных доменов (ТАДов), петель и компартментов.
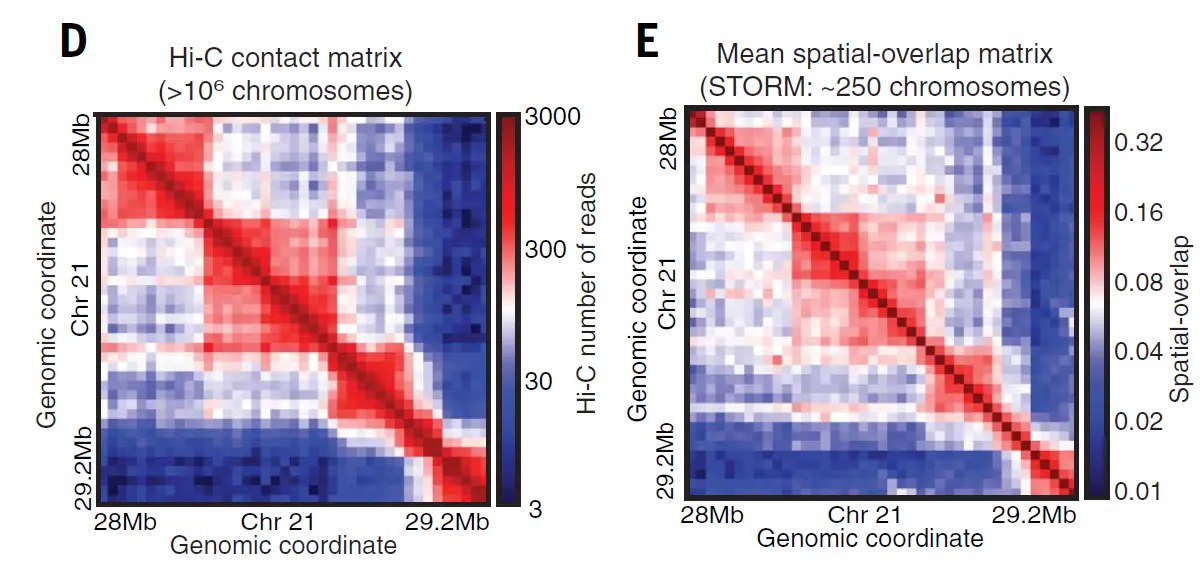
По всей видимости, ключевую роль в формировании ТАДов и петель у млекопитающих играют белок CTCF и когезиновый комплекс. ТАДы исходно были обнаружены как статистический феномен, отражающий предпочтительную вероятность контактов между разными участками генома, что выявляется на специальных диаграммах — картах Hi-C.
Иллюстрации из статьи Bintu et al., 2018: D — карта контактов участка хромосомы 21 в популяции из миллиона клеток, полученная методом Hi-C. Е — карта контактов, полученная с помощью микроскопии сверхвысокого разрешения 250 клеток.
Однако в каждой отдельной клетке эти контакты могут отличаться от усредненной картины, полученной на популяции клеток. Кроме того, данные об организации генома в ТАДы до сих пор получали только на фиксированных клетках, методами Hi-C и FISH. Это «end-point» методы — наблюдение возможно только в конечной точке эксперимента, в противоположность наблюдению в реальном времени. Этими методами невозможно проанализировать одну и ту же клетку в разные моменты времени, поэтому до сих пор не изучен в реальном времени процесс образования ТАДов и петель и их динамика в отдельно взятой клетке.
В настоящее время мы создаем клеточные линии, на которых будет проводиться in vivo визуализация локусов ДНК при разборке и восстановлении ТАДов и петель хроматина. Анализ движения этих локусов позволит уточнить механизмы сборки и разборки ТАДов и петель хроматина.
Для сборки и разборки ТАДов применяется система AID-деплеции. Она основана на индуцируемом ауксином убиквитинилировании целевого белка, что ведет к его деградации в протеасоме. Для убиквитинилирования целевой белок должен быть слит с дегроном — специальной аминокислотной последовательностью, узнаваемой убиквитин-лигазным комплексом. Также в клетках должна экспрессироваться распознающая ауксин и дегрон субъединица этого комплекса, ген которой взят у растений. Получение данной клеточной линии достигается методами генетической инженерии.
Изучение и реконструкция в микроорганизмах стероид-продуцируюущих систем млекопитающих
По этому направлению группа сотрудничает с НИИ ФХБ им.Белозерского и с белорусскими коллегами в рамках международного гранта РФФИ.
Удалось создать серию векторов, позволяющих экспрессировать три отдельных белка в форме самопроцессирующегося полипотеина, реконструировать холестерин гидроксилазно-лиазную систему млекопитающих в клетках бактерий и дрожжей и добиться ее неплохой активности.
Это открывает возможность синтеза фармакологически значимых стероидных препаратов биотехнологическим способом, что на порядки дешевле и эффективнее современных методик химического синтеза.
Другие проекты
Законченные или приостановленные проекты
Изучение роли белков клеточной адгезии в метастазировании опухолей. Создание для медицинского применения молекул, адресующих в клетки опухоли
Роль гликопротеида MUC1 в метастазировании
В рамках этого направления были созданы клеточные модели – «искусственные метастазы» для исследования роли экстрацеллюлярного домена известного гликопротеида MUC1 в метастазировании. Считается, что данный белок гиперэкспрессирован в раковых клетках железистых органов и влияет на их способность к метастазированию. Однако данное влияние исследовано слабо по причине отсутствия адекватных клеточных моделей. В лаборатории были созданы клеточные линии, презентирующие на поверхности различные варианты домена муцина MUC1. Для оценивания их метастатического потенциала измеряется их способность к миграции сквозь слой искусственно выращенного эндотелия сосудов (HUVEC, трансэндотелиальная миграция in vitro).
Белок SAV-RGD: стрептавидин, слитый с меланома-адресующим RGD-пептидом
В нашей лаборатории был получен рекомбинантный белок SAV-RGD, содержащий стрептавидин и меланома-адресующий RGD-пептид, и продемонстрирована способность этого белка узнавать клетки меланомы человека (MeWo, MelCher). Также была установлена его основная мишень — интегрин αvβ3. Связывание с таким белком вызывает кластеризацию рецепторов на поверхности клеток меланомы, интернализацию белка и приводит к снижению выживаемости таких клеток. В сотрудничестве с РОНЦ им.Блохина в 2014 г были успешно закончены доклинические исследования потенциального препарата.
В составе группы работают
Марина Сергеевна Сыркина (krimsy@yandex.ru), старший научный сотрудник.
Дезаминаза Aid как источник генетической нестабильности опухолей
Отличительное свойство опухолей — их генетическая нестабильность. Одним из процессов, вызывающим как генные мутации, так и хромосомные перестройки, является дезаминирование цитозина в урацил. Эта реакция может проходить при участии специальных ферментов – цитидин-дезаминаз семейства APOBEC, к которому относится белок AID (Activation-Induced Deaminase). Этот фермент в норме работает в активированных В-лимфоцитах, где индуцированный мутагенез нужен для повышения разнообразия антител и переключения их изотипа. B-клеточные лимфомы также часто имеют высокую активность AID, обуславливающую их онкогенные хромосомные перестройки. Патогенные микроорганизмы, такие как Helicobacter pylori, активируют рецепторы врожденного иммунитета и экспрессию AID в эпителиальных клетках с последующим мутагенезом, приводящим к малигнизации. В рамках проекта изучается вклад AID в этот процесс: происходит ли вызываемая рецепторами врожденного иммунитета активация AID и других белков семейства APOBEC в опухолях эпителиального, Т-клеточного и миелоидного происхождения; отличается ли механизм её активации от физиологического механизма в B-клетках.
Работа проводилась в сотрудничестве с кафедрой иммунологии МГУ и университетом Сириус в рамках совместного гранта РФФИ и фонда «Талант и успех».
Наша группа получила клеточные линии для изучения работы AID: линии с нокаутом гена Aid и линии со сверхэкспрессией. Также были получены генетические конструкции — внутриклеточные сенсоры, позволяющие оценить активность этого фермента.